رنت (مایه پنیر)
آنزیم رنت، رنین (کیموزین) يك آسپارتيك پروتئاز است كه آنزيم اصلي مورد استفاده در توليد پنير مي باشد. استفاده از رنت (Rennet) در صنايع غذايي به عنوان مایه پنیر، سابقه طولاني دارد و در تمام دنيا براي عمليات پنيرسازي ضروري است. افزودن اين آنزيم به شير سبب افزايش سرعت انعقاد كازئين، پروتئين اصلي شير، ميشود. رنين افزون بر انعقاد شير، نقش مهمي در رسيدگي پنير نيز ايفا ميكند.
تاریخچه انعقاد شیر
در طول تاریخ از مواد آلی بسیاری برای انعقاد شیر استفاده شده است. پنیرسازان بریتانیایی قرن هجدهم به عنوان مایه پنیر، حلزونهای سیاه را به شیر خود اضافه کردند (حلزون ها ظاهراً یک آنزیم انعقادی تولید میکنند). در دهه 1940 میلادی از بینیت یا مایه پنیر گوساله و همچنین از بینیت اواین یا مایه پنیر بره استفاده میشد.
کازئین شیر
عمده ترین ترکیب پروتئین شیر کازئین است. میسلهای کازئین دو نوع هستند:
- کازئین حساس به کلسیم و
- کازئین غیرحساس به کلسیم (کاپاکازئین) میباشند.
کاپاکازئین مهم ترین نوع کازئین است که نقش مهمی در تهیه پنیر ایفا میکند وحساسیت کمی به کلسیم دارد. این نوع کازئین، از آن جهت که موجب میشود میسلها در شیر به صورت معلق درآیند و رسوب نکنند فاکتور پایدارکننده ( Factor Stabilizing )نامیده میشوند. سطح خارجی میسلها توسط کاپاکازئین که به نوعی اثر حفاظت کنندگی در جلوگیری از رسوب دارد، احاطه میشود.
انعقاد شیر
انعقاد كازئين شير در دو مرحله صورت ميگيرد:
- مرحله آنزيمي
- مرحله غير آنزيمي
در مرحله آنزيمي كازئين توسط رنين به شكل كاپاكازئين در ميآيد و در مرحله غير آنزيمي از طريق يون كلسيم و حرارت مناسب منعقد ميشود. در حقیقت آنزیم رنت پیوند بین فنیل آالانین و متیونین (اسیدآمینههای شماره 105 و106) را درکاپا کازئین میشکند و کاپاکازئین را به دو بخش آبگریز و آبدوست تجزیه میکند. قسمت آبگریز زنجیر پپتیدی بین اسید آمینه 1 تا 105 پاراکاپا کازئین نامیده شده و نامحلول است و در لخته پنیر میماند. قسمت آبدوست زنجیر پپتیدی بین اسیدآمینه 105تا 115 است که به آن کازئینوماکرو پپتید میگویند. باتجزیه کاپا کازئین، قدرت محافظت کنندگی آن در برابر سایر کازئینها برای جلوگیری از رسوب ازبین میرود؛ دذ نتیجه در حضور یون کلسیم رسوب می کند و با ایجاد لخته، آب پنیر خارج میشود.
منشا انواع رنت
حیوانی
مایه پنیر، آنزیمی است که معمولاً از پوشش معده چهارم حیوانات جوان نشخوارکننده مانند بز، بره، گوساله و غیره به دست میآید. این آنزیم فقط در حیوانات جوانی یافت میشود که هنوز به شیر به عنوان منبع اصلی غذا وابسته هستند.
گیاهی
به غیر از حیوانات، شواهد نشان میدهد که این آنزیم در گیاهان خاصی مانند کنگر فرنگی، گزنه و خار مریم نیز وجود دارد. آنزیم از منبع گیاهی اغلب برای تهیه پنیر برای رژیم گیاهخواری استفاده میشود.
میکروبی
در حال حاضر صنايع لبني به طور گسترده از رنين ميكروبي توليد شده از منابع قارچي به خصوص رايزوموكور پوسيلوس (Rhizomucor pussillus)، رایزوموکور میهی (Rhizomucor miehei)، اندوتيكا پارازيتيكا (parasitica Endothica)، آسپرژيلوس اوريزا (Aspergillus oryzae) و آيرپكس لاكتيس (Irpex lactis) و نیز رنین نوترکیب تولید شده در میکروارگانیسمها استفاده میکند. رنینهای میکروبی به آسانی با روش تخمیر، تولید شده و پایداری حرارتی بیشتر، دسترسی سادهتر و مقرون به صرفه بودن، ماندگاری طولانیتر نسبت به رنتهای حیوانی و عملکردمشابه دارند و میتوانند جایگزین خوبی برای رنتهای حیوانی باشند.
رنت مورد استفاده در صنعت
آنزيم كيموزين یا همان رنت استحصال شده از شيردان گوساله به طور سنتي به عنوان آنزيم لخته كننده شير براي توليد پنير استفاده ميشود. در واقع تعداد زيادي از پروتئازها قادر به تجزيه پروتئين هاي شير و توليد لخته در آن مي باشند، اما اين ويژگي به تنهايي جهت استفاده از آنها در صنعت پنيرسازي كافي نيست. مايه پنير خوب بايد داراي ويژگي هايي مثل حلاليت بالا در آب، فعاليت انعقاد بالا، فعاليت پروتئوليتيكي مناسب، ايجاد عطر و طعم مطلوب و قابليت نگهداري بالا باشد. علاوه بر اين، محدودیتی برای توليد آن وجود نداشته باشد. رنين حاصل از منابع گياهي به دليل فعاليت پروتئوليتيكي زياد و در نتيجه ايجاد تلخي در پنير به دليل آزاد سازي برخي پپتيدهاي نامطلوب در اثر تجزيه پروتئين هاي شير، چندان مورد توجه قرار نگرفته است. به همین دليل صنعت لبنیات همواره به دنبال جايگزين مناسبي براي آنزيم رنين بوده است و از اين نظر آنزيمهاي لخته كننده با منشاء ميكروبي از اهميت زيادي برخوردارند.
نحوه عمل مایه پنیر
عملکرد اولیه مایه پنیر، بر مبنای انعقاد کازئین از طریق برش اختصاصی κ-کازئین است. پروتئاز، یکی از آنزیمهای کلیدی موجود در مخلوط آنزیمهای مایه پنیر است که مسئول انعقاد شیر است، زیرا باعث انعقاد کازئین موجود در شیر میشود. کازئین یکی از پروتئینهای اصلی شیر است و عمل آنزیم مایه پنیر باعث می شود که این پروتئین با سایر مولکولهای کازئین ترکیب شود و در نتیجه شبکهای تشکیل شود و باعث انعقاد شیر شود.
شیمی کیموزین
کیموزین گاوی یک آسپارتیل پروتئاز است که از شیردان (معده چهارم) گوساله های شیرخوار استخراج می شود. این آنزیم به شکل طبیعی خود به عنوان یک پیش ساز غیر فعال به نام پروکیموزین ترشح می شود که در نتیجه پروتئولیز به طور برگشت ناپذیر به کیموزین فعال تبدیل میشود. این آنزیم دارای فعالیت انعقاد شیر بسیار بالایی است اما فعالیت پروتئولیتیک پایینی دارد. این ویژگیها کیموزین را برای استفاده در ساخت انواع پنیر (پنیر پیتزا، چدار، سفید، UF و غیره) مناسب میکند. کیموزین به صورت پروکیموزین ترشح میشود، یک زیموژن غیرفعال که 365 اسید آمینه طول دارد. در pH اسیدی، این پیشساز تحت فعالسازی اتوکاتالیستی قرار میگیرد تا کیموزین (با طول 323 اسید آمینه در مقادیر pH حدود 5.0) یا پسودوکیموزین (طول 337 اسید آمینه در مقادیر pH حدود 2.0) را تشکیل دهد. کیموزین و پسودوکیموزین هر دو میتوانند شیر را لخته کنند.
کیموزینهای نوترکیب
پژوهشگران صنعت غذایی ژن کیموزین را در تعدادی از میکروارگانیسمها شبیه سازی و بیان کردند. کیموزینهای نوترکیب با موفقیت در میکروارگانیسمهای اصلاح شده ژنتیکی مانند اشریشیا کلی، آسپرژیلوس awamori و Kluyveromyces lactis تولید شدهاند. صنایع لبنی در حال حاضر از رنینهای میکروبی تولید شده از منابع قارچی به طور گسترده برای کاربردهای لخته شدن شیر استفاده میکنند، به ویژه رنینهای R. pusillus، Rhizomucor miehei، Endothia parasitica، A. oryzae و Irpex lacti. برخی از کیموزینهای نوترکیب تجاری موجود عبارتند از:
- رنت CHY-MAX® حاصل از تخمیر coli K
- رنت Chymogen® و ChymoStar® حاصل از تخمیر niger var. awamori
- رنت Marxian حاصل از تخمیر marxianus var
- رنت آنزیمکس (Enzymax) حاصل از تخمیر Mucor Miehei
هیچ تفاوت عمدهای در عملکرد بین پنیرهای ساخته شده با کیموزین کلون شده و پنیرهای ساخته شده با آنزیم طبیعی مشاهده نشده است.
جایگزین رنت
ویژگیهای پپسین در کل شبیه به کیموزین است. پپسین گاوی پیوندهای Leu109-Glu110 aS1-casein را خیلی سریعتر از کیموزین میشکافد. پپسین یک پروتئاز است که میتواند شیر را لخته کند. این آنزیم توسط غشای مخاطی معده گراز و گاو به عنوان یک پپسینوژن غیرفعال کاتالیزوری ترشح میشود. پپسین در محلولهای خنثی و کمی قلیایی پایدار است، اما در دمای بالای 55 درجه سانتیگراد در pH 7.0 و در دمای اتاق در pH 11.0 به طور برگشتپذیر دناتوره میشود. اگرچه پپسین میتواند شیر را لخته کند، اما استفاده از آن تمایل به کاهش چربی شیر دارد، زیرا کشک بهدستآمده ساختار بازتر و شلتری نسبت به کیموزین دارد. پنیر تولید شده با استفاده از پپسین بافت نرمتر از حد مطلوب دارد.
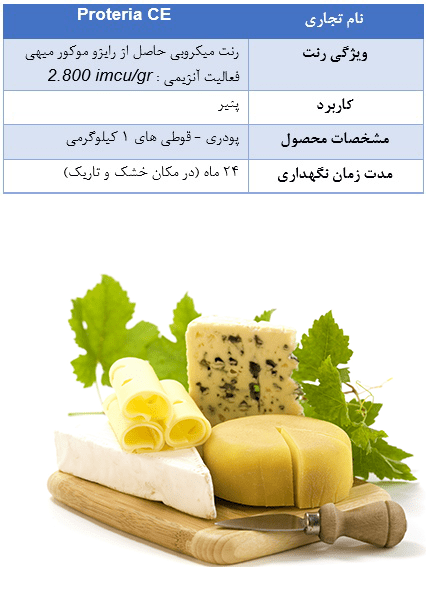
Proteria CE
یک رنت میکروبی است که از قارچ رایزوموکور میهی (miehei Rhizomucor)به دست می آید. در بین جنس های مختلفی از قارچ ها که میتوانند با تولید آنزیم شیر را منعقد کنند یکی از بهترین آن ها قارچ رایزوموکور میهی (miehei Rhizomucor) است که رنین به دست آمده از آن بسیار زیاد در تولید پنیر استفاده میشود وجایگزین مناسبی برای رنت حیوانی به شمار می آید.رنین حاصل از قارچ رایزوموکور میهی (Rhizomucor miehei) به دليل فعاليت لخته كنندگي بالا، فعاليت پروتئازي كم و نيز مقاومت حرارتي بالاتر نسبت به ساير پروتئازهاي قارچي در صنعت توليد پنير، توجه بسیاری را به خود معطوف كرده است.