ترانس گلوتامیناز (TG)
پروتئینها اجزای مهم غذایی هستند که نقش مهمی در خواص فیزیکوشیمیایی غذا ایفا میکنند. استفاده از ترانس گلوتامنیاز یا همان TG برای ایجاد پیوند بین پروتئینهای غذایی برای تغییر ویژگیهای عملکردی و رئولوژیکی آنها بیش از 30 سال است که در صنعت انجام میشود. TG تشکیل پیوندهای عرضی را در یک مولکول و همچنین بین مولکولهای پروتئینهای دیگر کاتالیز میکند. این ویژگی بر تغییرات عملکردهای پروتئین مانند حلالیت، کف کردن، ظرفیت امولسیون و ژل شدن تأثیر می گذارد. ترانس گلوتامیناز خواص عملکردی پروتئینها را تغییر میدهد و در نتیجه باعث بهبود رئولوژی و سایر خواص کیفی محصولات مختلف غذایی میشود.
آنزیمها
آنزیمها مدتها قبل از توسعه فناوری مدرن DNA به عنوان میکروارگانیسمهای تخمیر کننده یا فرآوری میوههای خام مورد استفاده قرار میگرفتند. با این حال، با توسعه فرآیندهای زیستی پیشرفته با استفاده از فناوری DNA نوترکیب، آنزیمها در مقیاس بزرگتری در حال خالصسازی و تولید هستند. همین امر امکان استفاده و کاربرد آنها را در صنایع مختلف از جمله صنایع شیمیایی، غذایی، نساجی، آرایشی و خمیر کاغذ فراهم کرده است.
پروتئازها
توسعه مهندسی پروتئین با تکامل مبتنی بر محل تاثیر، باعث طراحی و گسترش آنزیمهای جدید با ویژگیهای پیشرفته برای بسیاری از فرآیندهای صنعتی نوین شده است. از جمله آنزیمهای صنعتی پرمصرف میتوان به هیدرولازها و کربوهیدراز ها اشاره کرد. هیدرولازها، مانند لیپازها و پروتئازها، در بسیاری از صنایع غذایی، عمدتاً لبنیات، و همچنین در صنایع شوینده و شیمیایی مورد استفاده قرار میگیرند. کربوهیدرازها شامل آمیلازها و سلولازها باعث بهرهوری انرژی و صرفه جویی در مصرف آب و مواد خام شدهاند. از نظر کاربرد هیدرولازها در صنعت، پروتئازها اصلیترین آنزیمهای اصلاح کننده پروتئین هستند. با ظهور آنزیم M، که در اتصال عرضی پروتئین نقش دارد، فناوری اصلاح پروتئین بسیار توسعه یافته است.
ترانس گلوتامیناز میکروبی
مزایای اصلی تولید TG از میکروارگانیسمها در مقایسه با تولید از منابع حیوانی و گیاهی، خلوص و بالا بودن بهرهوری آن است و نیازی به فرآیندهای جداسازی و فیلتراسیون دشوار و هزینه بر نیست. فناوری انتقال ژن نیز تولید TG را تسهیل کرده است، جایی که بیان ژنها در E. coli تولید TG و کارایی آنها را به شدت افزایش داده است. ترانس گبوتامیناز میکروبی برای صنعت مطلوب هستند و زیست تخریب پذیری آنها به آنزیمهای شیمیایی برتری دارد. رگههایی از آنزیم ترانس گلوتامیناز میکروبی را میتوان در یوکاریوتهای آغازین و برخی گونههای مخمر و باکتری یافت.
کارکرد ترانس گلوتامیناز
واکنشهای کاتالیزشده با TG منجر به تغییرات ویژگیهای عملکردی، مانند حلالیت کف، ویسکوزیته، الاستیسیته، ظرفیت نگهداری آب، ظرفیت امولسیون، ژل شدن و پایداری حرارتی پروتئینهای مختلف غذایی میشود. همچنین ترانس گلوتامیناز در بسیاری از فرآیندهای فیزیولوژیکی، مانند واکنشهای ایمنی ضد باکتریایی انعقادی و فتوسنتز نقش دارد. ترانس گلوتامینازها آنزیمهایی هستند که هم در داخل و هم در خارج سلول یافت میشوند که همین نشاندهنده تطبیق پذیری عملکرد آنها است.
منابع استحصال آنزیم ترانس گلوتامیناز
ترانس گلوتامیناز را میتوان در گیاهانی مانند سویا، کنگر و چغندر، در حیواناتی مانند ماهی و همچنین در میکروارگانیسمها یافت. TG از منابع پستانداران وابسته به یون کلسیم هست، در حالی که ترانس گلوتامینازهای میکروبی مستقل از یون کلسیم هستند و وزن مولکولی پایینتری دارند. با توجه به عدم وابستگی به یون کلسیم، ترانس گلوتامینازهای میکروبی مقرون به صرفهتر هستند و سازگار با محیط زیست در نظر گرفته میشوند. ترانس گلوتامینازهای یوکاریوتی در گروههای فیلوژنتیکی مانند گیاهان، حیوانات و قارچها یافت میشوند. TGهای پروکاریوتی در میکروارگانیسمها یافت میشوند. TG اولین بار در سال 1989 از S. mobaraensis استحصال شد و بعداً در بسیاری از سویههای دیگر یافت شد.
خواص فیزیکوشیمیایی ترانس گلوتامیناز میکروبی
TG میکروبی دارای فعالیت کاتالیزوری پایدار در محدوده وسیعتری از مقادیر pH در مقایسه با TG حیوانی است. فعالیت pH بهینه TG میکروبی در محدوده 5 تا 7 و دارای نقطه ایزوالکتریک 8 است. فعالیت کاتالیزوری بهینه TG در محدوده دمایی 40 تا 50 درجه سانتیگراد، در pH 6 قرار دارد. هنگامی که دما بیش از حد افزایش مییابد مثلا در دمای 70 درجه سانتیگراد، فعالیت کتالیزوری این آنزیم به شدت کاهش مییابد. آنزیم ترانس گلوتامیناز واکنش اتصال عرضی (درون مولکولی و بین مولکولی) در پروتئینها را سنتز میکند. ترانس گلوتامیناز مسئول انتقال آسیل، بین پپتید گلوتامین (دهنده آسیل) و پپتید لیزین (پذیرنده آسیل) است. این آنزیم باعث تشکیل ایزوپپتیدها و پلیمرهای گلوتامیل لیزین با وزن مولکولی بالا میشود.
محیط کشت آنزیم ترانس گلوتامیناز میکروبی
محیط مورد استفاده برای تولید TG میکروبی حاوی عصاره مخمر، پپتون، پتاسیم و فسفات سدیم، سولفات منیزیم و منبع کربن است. منبع کربن میتواند مواد زائد کشاورزی و یا زایلوز باشد که یک قند همی سلولزی است که برای تکثیر باکتریها استفاده میشود. همچنین ساکارز، گلوکز، نشاسته یا دکسترین به عنوان منبع کربن استفاده میشوند. امروزه TG معمولا توسط Streptovitricillium mobaraense در سیستمهای تخمیر تولید میشود که حاوی ذرت، آمونیاک و عصاره مخمر به عنوان منبع نیتروژن است. پپتون، عصاره مخمر، اوره و کازئین نیز معمولاً به عنوان منابع نیتروژن در بیوسنتز TG استفاده میشوند. ترانس گلوتامیناز میتواند توسط بسیاری از میکروارگانیسمها مانند Streptoverticillium sp.، Streptoverticillium cinnamoneum، Streptomyces netropsis، Streptoverticillium ladakanum، Streptomyces lydicus و Bacillus subtilis بیوسنتز شود.
کاربردهای آنزیم ترانس گلوتامیناز
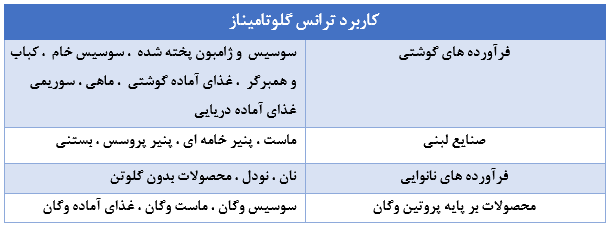
در صنایع غذایی، نقش آنزیم اصلاح کننده پروتئین را ایفا میکند. در بیوتکنولوژی و داروسازی، به دلیل قابلیت اتصال عرضی فوق العاده از آن در بیوکونژوگاسیون واسطهای استفاده میشود. همچنین میتوان از آن برای تولید فیلمهای خوراکی کامپوزیتی استفاده کرد؛ استحکام بافت پنیر را بهبود و به نان قوام میبخشد. با کاهش ویسکوزیته و افزایش حلالیت در فورمولاسیون نوشیدنیها موثر عمل میکند و همچنین باعث کاهش آب اندازی ماست میشود. از آنجایی که آنزیم ترانس گلوتامیناز سوبسترای وسیعی دارد در محصولات مختلفی نظیر لبنیات (شیر، ماست، پنیر خامه ای، پنیر پروسس، بستنی )، فرآوردههای گوشتی (کالباس، ژامبون پخته شده، سوسیس خام، کباب، غذای آماده گوشتی، ماهی، سوریمی و انواع غذای آماده دریایی) کاربرد دارد.این آنزیم در فرآوری نودل ،محصولات بدون گلوتن و محصولات بر پایه پروتئین وگان (سوسیس وگان، ماست و غذای آماده وگان) نیز مورد استفاده قرار میگیرد.
تثبیت آنزیم ترانس گلوتامیناز
تثبیت TG روی تکیهگاههای جامد یک روش پرکاربرد برای افزایش پایداری و بهبود طیف مصرف آن است. تثبیت آنزیم بر روی یک ماتریس مشخص، به آنزیم کمک میکند تا در برابر تغییرات دما و pH مقاومت نشان دهد و پایداری ساختار و فعالیتهای کاتالیزوری را حفظ کند. آنزیمهای تثبیتشده در مقایسه با فرم آزاد آنزیم، پایدارتر هستند و از نظر خواص حرکتی، بهینهتر عمل میکنند. ترانس گلوتامیناز تثبیت شده افزایش فعالیت، ثبات و گزینشپذیری نشان میدهد. بنابراین در مقیاسهای بزرگ و صنعتی، آنزیمهای تثبیتشده ایدهآل هستند. TG تثبیت شده بر روی چند تکیه گاه، مانند پلی کربوکسیله مقاوم به حرارت (N-isopolylacrylamide)، آگارز، غشاهای ریز متخلخل پلی پروپیلن و نانوذرات مغناطیسی (MNPs) یا نانولولههای کربنی (CNTs) تا به حال مورد آزمایش قرار گرفتهاند. در میان این روشها، بالاترین راندمان تثبیت 58 درصد به دست آمد و افزایش 4.8 برابری در راندمان کاتالیزوری مشاهده شد.